Un ensayo en etapa avanzada de un medicamento para el Alzheimer que generará resultados en cuestión de semanas se perfila como un momento crucial en una búsqueda de tres décadas para demostrar que la eliminación de las placas amiloides pegajosas del cerebro puede ralentizar la enfermedad.
El ensayo de fase 3 está dirigido por Eisai, una compañía farmacéutica con sede en Tokio que se ha asociado con la biotecnológica estadounidense Biogen para desarrollar lecanemab. Estudios anteriores sugirieron que el tratamiento con anticuerpos monoclonales puede eliminar las placas conocidas como beta amiloide que están en el centro de un debate científico cada vez más enconado sobre las causas del Alzheimer.
Un resultado positivo podría conducir a la aprobación de un nuevo medicamento para una enfermedad que afecta a 50 millones de personas en todo el mundo y que no tiene cura conocida. Sería alentador para Eli Lilly y Roche, que están realizando ensayos con medicamentos similares que podrían generar decenas de miles de millones de dólares en ventas si se demuestra que retrasan la progresión de la enfermedad de Alzheimer.
Pero los científicos dicen que los resultados decepcionantes de las pruebas darían un golpe significativo a la llamada hipótesis amiloide, la idea de que la eliminación de grupos de células tóxicas que se unen en el cerebro puede disminuir la tasa de deterioro cognitivo en los pacientes.
Alberto Espay, profesor de neurología en la Universidad de Cincinnati, dijo que algunos investigadores se habían apegado demasiado a la hipótesis del amiloide, que ha sido probada en docenas de estudios que no han podido proporcionar pruebas concluyentes de que la eliminación de las placas frena el deterioro cognitivo.
“Nos hemos topado con un dogma”, dijo. “Y es muy difícil probar nuevas ideas cuando el tema general de la financiación se centra en la idea de que eliminar el amiloide debe ser el único camino a seguir”.
Los resultados decepcionantes también podrían actuar como un catalizador para un cambio en la financiación de la investigación del Alzheimer, y algunos científicos argumentan que las áreas prometedoras de estudio y los tratamientos potenciales han sido desplazados por el enfoque de Big Pharma en el amiloide.
La hipótesis amiloide es la más probada de las muchas teorías sobre las causas del Alzheimer, que van desde la inflamación de algunos tipos de células cerebrales hasta la presencia y formación de varias proteínas en el cerebro. Ha sido el foco de más de una quinta parte de los más de 2000 ensayos clínicos relacionados con la enfermedad a partir de 2019.
El lanzamiento fallido el año pasado del aducanumab de Biogen, el primer fármaco de eliminación de amiloide en obtener la aprobación y el primer tratamiento nuevo para la enfermedad en casi dos décadas, solo ha servido para aumentar las dudas sobre medicamentos similares.
Aducanumab, que se vende bajo la marca Aduhelm, recibió luz verde por la vía rápida por parte de los reguladores de EE. UU. a pesar de las dudas sobre su eficacia y la solidez de dos ensayos clínicos en etapa avanzada que respaldaron su aprobación. El escepticismo generalizado entre los médicos se profundizó aún más cuando la empresa fijó el precio del tratamiento en 56.000 dólares al año, una medida que también provocó una reacción violenta entre políticos y legisladores.
En abril, las autoridades estadounidenses asestaron un duro golpe a Aduhelm al restringir severamente el reembolso de los planes de salud financiados por el gobierno, una medida que limita su uso a unos pocos miles de personas que participan en ensayos clínicos. Cualquier tratamiento de amiloide similar aprobado bajo el procedimiento acelerado de la FDA enfrentaría las mismas restricciones, un obstáculo que Eisai reconoce que complica el proceso de aprobación de lecanemab.
“Sí, admito que eleva el listón. Por eso el diseño del ensayo. . . es tan importante”, dijo Ivan Cheung, director ejecutivo estadounidense de Eisai, en una entrevista.
En un intento por ganarse la confianza del público, Eisai está realizando uno de los ensayos más grandes jamás realizados sobre un medicamento para el Alzheimer, inscribiendo a 1.795 pacientes en las primeras etapas de la enfermedad. También ha dejado de lado a su socio Biogen al asumir lo que Cheung describe como «autoridad de toma de decisiones final» a medida que el medicamento avanza a través del proceso regulatorio.
Eisai tiene como objetivo igualar o mejorar los resultados de un ensayo anterior que mostró que dar a los pacientes una dosis de 10 mg de lecanemab cada dos semanas durante 18 meses puede reducir la tasa de deterioro cognitivo en un 26 por ciento, en comparación con aquellos que recibieron un placebo.
Utiliza la escala Clinical Dementia Rating para medir los síntomas de demencia en pacientes en seis categorías, que incluyen memoria, juicio y resolución de problemas.
Los críticos alegan que esta escala es un mecanismo impreciso y cuestionan si vale la pena aprobar medicamentos amiloides que pueden reducir solo ligeramente el ritmo del deterioro cognitivo y que pueden causar efectos secundarios potencialmente mortales.
Pero grupos de pacientes como la Asociación de Alzheimer dicen que incluso los retrasos relativamente pequeños en la progresión de la enfermedad pueden brindar beneficios significativos a las personas que padecen una enfermedad terminal.
“Podría significar seis meses más en esa etapa en la que puede mantener su independencia, disfrutar de su familia y asistir a una boda”, dijo María Carrillo, directora científica de la Asociación de Alzheimer.
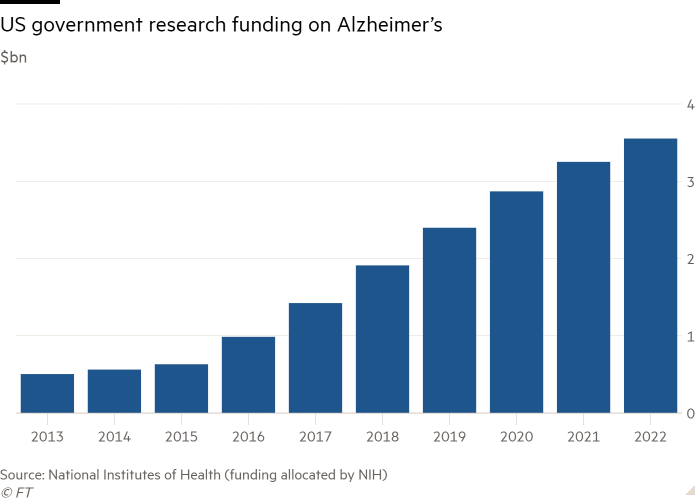
A pesar de la controversia sobre Aduhelm, Carrillo dijo que era un momento alentador para la investigación de la enfermedad de Alzheimer y señaló el aumento de la financiación del gobierno y los hallazgos clave de los ensayos clínicos.
Eisai dijo que después de la controversia de Aduhelm, un resultado que muestre una tasa de desaceleración por debajo del 25 por ciento podría «problemar» su solicitud de la FDA para la aprobación acelerada de lecanemab, un proceso que debe concluir en enero.
Bajo este proceso acelerado, la FDA podría aprobar el medicamento sobre la base de que reduce la placa amiloide y solo es «razonablemente probable» que prediga un beneficio clínico. Esos fueron los mismos criterios utilizados para aprobar Aduhelm, una decisión controvertida que provocó la renuncia de tres miembros de un comité que asesora a la FDA sobre el medicamento.
Cheung dijo que confiaba en que el ensayo con lecanemab sería un éxito y pidió que los escépticos del amiloide estudien los datos antes de emitir un juicio. “Todo debe estar basado en hechos. . . Espero que tengamos un debate justo”, dijo.
Para Biogen, el éxito podría ayudar a reconstruir su reputación empañada tras el desastroso lanzamiento de Aduhelm, que provocó una reducción de costos de mil millones de dólares, la partida de su director ejecutivo y investigaciones por varias agencias gubernamentales de EE.
Ronald Petersen, director del Centro de Investigación de la Enfermedad de Alzheimer de la Clínica Mayo, dijo que si el ensayo de lecanemab fue «totalmente negativo», entonces no sería bueno para la «hipótesis amiloide». Pero dijo que no enterraría la teoría por completo debido a los próximos resultados de los ensayos en etapa avanzada de tres medicamentos de Roche y Eli Lilly.
Petersen dijo que su mejor suposición era que uno de los ensayos mostraría un impacto clínico positivo, aunque de magnitud modesta.
“Esto nos daría un pie en la puerta para los tratamientos porque, en última instancia, en el futuro se necesitará una terapia combinada para tener un voila tipo de efecto”, dijo.
“Si los cuatro de estos [trials] realmente no muestran evidencia de ningún tipo de impacto clínico. . . solo puede sugerir que probablemente deberíamos buscar objetivos clínicos en otro lugar”, agregó.